Architecture commune à plusieurs investigations cliniques, le master protocol commence à être utilisé dans le domaine du dispositif médical. Le groupe MultiHealth expose dans cet article de quoi il s’agit et souligne les avantages que les promoteurs peuvent en retirer.
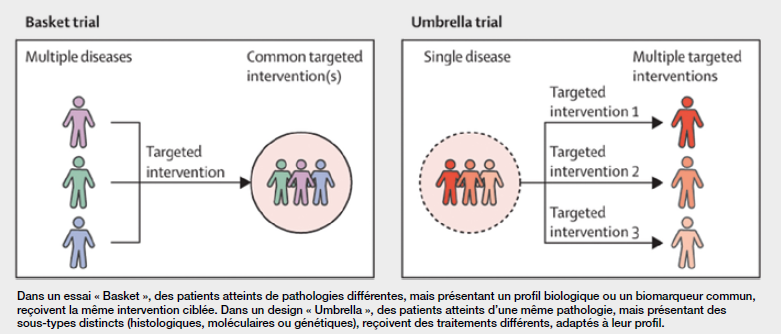
Historiquement réservé aux traitements médicamenteux en oncologie, le master protocol, traduit en français par protocole-maître, protocole-cadre ou protocole-directeur, est désormais exploré dans d’autres domaines, notamment celui des dispositifs médicaux. Le design d’investigations cliniques basées sur master protocol vise à accroître l’efficacité en matière d’infrastructure d’essais et de gestion de protocoles, et à optimiser le développement des innovations techniques et technologiques. Le concept de master protocol s’est imposé dans les années 2010 avec le développement de designs innovants tels que les études basket, umbrella (voir Figure) et platform. Ces designs adaptatifs permettent d’évaluer un même traitement pour plusieurs maladies (basket), plusieurs traitements pour une même maladie (umbrella), ou plusieurs traitements et maladies de façon adaptative (platform)1. Le master protocol définit le cadre général de l’étude : objectifs, méthodologie, critères d’évaluation, processus d’analyse. Il ne comprend pas les détails spécifiques à une indication ou à un produit. Ces éléments sont inclus dans des sous-protocoles indépendants, chacun correspondant à une sousétude ciblée. Chaque sous-protocole peut être développé, soumis à un comité d’éthique et mis en oeuvre plus rapidement, car il s’inscrit dans une structure déjà approuvée.
Un cadre mieux reconnu depuis l’année 2022.
L’approche a gagné en reconnaissance lorsque la FDA a publié en mars 2022 une guideline officielle sur l’utilisation de ces protocoles dans les études n oncologie3. Ce document fournit des recommandations sur la conception, la sécurité, les aspects réglementaires et les interactions avec la FDA pour garantir des essais bien structurés, sûrs et efficaces, capables de soutenir des demandes d’autorisation de mise sur le marché. Dans la foulée, en mai 2022, l’EMA a publié un document « Questions & Answers on Complex Clinical Trials (CCT) », dans lequel elle traite explicitement de la notion de master protocol4. L’ICH5 vise à harmoniser les formats de protocole (e Protocol Template via l’ICH M11) et à favoriser la structuration des essais, offrant ainsi un cadre favorable aux approches modulaires de type master protocol6 .
Les atouts du master protocol pour le dispositif médical.
L’entrée en vigueur du Règlement (UE) 2017/745 (MDR) a instauré un cadre rigoureux pour démontrer la sécurité et la performance d’un dispositif médical, aussi bien avant qu’après commercialisation.
Dans ce contexte, l’approche par master protocol offre plusieurs avantages :
- Mutualisation des ressources : sites, personnel, infrastructures de collecte de données (electronic data capture).
- Agilité méthodologique : ajout facilité de nouveaux produits ou de nouvelles indications en raison d’un cadre pré-existant décrit dans le master protocol.
- Cohérence des données : les sous-études suivent un cadre harmonisé, facilitant les comparaisons et les méta-analyses. Ce dernier point est très important pour capitaliser sur l’ensemble des données recueillies pour une pathologie, une gamme de produits…
Deux exemples de master protocol en cardiologie et en oncologie
Le recours à un protocole-cadre est encore assez anecdotique dans le secteur des dispositifs médicaux. Il existe cependant quelques exemples probants. MANTRA est une étude internationale post-marketing (PMCF) utilisant un master protocol dédié à trois dispositifs valvulaires : aortique, mitral, tricuspide. L’objectif de cette investigation est le suivi de la performance et de la sécurité à 30 jours et au long terme. Le concept de master protocol offre au fabricant/promoteur un cadre évolutif unique pour ajouter de nouvelles sous-études en fonction de ses besoins, et pour fournir des informations de suivi clinique post-commercialisation sur l’ensemble du portefeuille de valves cardiaques dans une base de données commune.
Dans sa revue, Bitterman et al. décrit un master protocol de phase I et II qui permet d’évaluer l’utilisation de la radiothérapie adaptative stéréotaxique guidée par Imagerie par Résonance Magnétique (IRM), sur des cancers à localisation différente : poumon, rein, pancréas7. Cette revue met en avant le cas spécifique des dispositifs de radiothérapie oncologique (Radiation Oncology Devices, RODs), difficiles à évaluer cliniquement en raison de plusieurs contraintes : hétérogénéité des patients et des traitements, forte dépendance à l’opérateur (ex. : technicien, radiothérapeute), et budgets réduits pour financer les essais. Pour faire face à ces limites, les auteurs recommandent l’usage de master protocols comme levier d’efficience réglementaire, financière, logistique et méthodologique.
Une démarche mieux adaptée aux exigences réglementaires actuelles
En conclusion, les master protocols représentent une opportunité stratégique pour la recherche clinique sur les dispositifs médicaux. Pour en maximiser les bénéfices, il est recommandé de planifier dès le départ une architecture modulaire et évolutive : chaque sous-protocole doit pouvoir être modifié sans impacter l’ensemble de l’étude, et les données doivent rester segmentables pour chaque bras. L’adoption progressive par les fabricants d’une telle démarche ouvre la voie à des programmes de développement clinique plus agiles, mieux harmonisés, et davantage alignés avec les exigences actuelles de preuve clinique.
1 Woodcock et al. N Engl J Med 2017;377:62-70. DOI: 10.1056/ NEJMra151006
2 Recommendations for planning and conducting clinical trials with master protocol designs: Umbrella, Basket and Platform Trials. ERA4Health booklets. Juillet 2025
3 Master Protocols: Efficient Clinical Trial Design Strategies to Expedite Development of Oncology Drugs and Biologics Guidance for Industry-Guidance for Industry- March 2022
4 EMA – Complex clinical trials – Questions and answers Version2022-05-23
5 ICH : International Council for Harmonisation of Technical Requirements


